 | Laboratorio di Analisi Veterinarie |
Modalità di campionamento e materiale scientifico
CERULOPLASMINA COAGULATIVO SDSAGE
 ESAME CITOLOPATOLOGICO 1
ESAME CITOLOPATOLOGICO 1
Di seguito sono riportate alcune indicazioni utili per un idoneo allestimento ed invio dei preparati citopatologici.
• Tipo di prelievo:
la preparazione di un campione citologico non prevede un metodo elettivo di prelievo, in generale il metodo deve essere scelto in base alla presentazione clinica della lesione, sua localizzazione e sua cellularità.
I campioni allestiti da liquidi organici, fra cui liquido peritoneale e pleurico, devono essere sempre inviati in una provetta contenente K3Edta (provetta da emocromo), al fine di evitare la formazione di coaguli che ostacolano la lettura esatta della cellularità. Se possibile, inviare contestualmente anche uno striscio tal quale del campione stesso, eseguito al momento del campionamento e fatto asciugare rapidamente all'aria.
I campioni effettuati da midollo osseo devono sempre essere accompagnati da un emocromo del soggetto, prelevato nello stesso giorno.
• Tipo di vetrino da utilizzare:
preferibilmente, i vetrini da utilizzare sono quelli che presentano la banda sabbiata in cui inserire l'identificativo, rigorosamente a matita (mai a penna o pennarello). Laddove possibile, eseguire almeno 3 preparati da ciascuna lesione, da inviare già fissati all'aria e non colorati. Se si inviano campioni già colorati, specificare il tipo di colorazione eseguita ed inviare contestualmente altri campioni non colorati, al fine di consentire al laboratorio stesso il processamento secondo metodiche standard, con eventuale ricorso a colorazioni differenziali.
• Scheda da allegare:
ricordarsi sempre di allegare una scheda con le seguenti informazioni (fondamentali per una refertazione adeguata):
1.segnalamento (specie, razza, età, sesso, organo del prelievo)
2.tipo di lesione (sede, dimensioni, aspetto macroscopico)
3.indicazioni sul tipo di prelievo effettuato (impronta, scarificato, agoaspirato/agoinfissione)
4.anamnesi (eventuali malattie presenti, evoluzione della lesione) eventuali sospetti diagnostici.
• Spedizione dei vetrini:
per l’imballaggio e la spedizione dei vetrini è buona norma utilizzare dei portavetrini rigidi (cartone o plastica), ed evitare di spedire i vetrini imballati con della semplice carta o liberi in delle scatole, riducendo al minimo il rischio di rottura durante la spedizione. Se si utilizzano portavetrini già utilizzati in precedenza, accertarsi che siano privi di detriti o residui oleosi all'interno, per non contaminare i nuovi preparati.
 ESAME CITOLPATOLOGICO 2
ESAME CITOLPATOLOGICO 2
ESAME CITOLOGICO CUTANEO E DI ORGANI
E' necessario inviare almeno tre preparati per ogni lesione cutanea o di organi, i campioni devono essere asciugati completamente all'aria.
ESAME CITOLOGICO LIQUIDO SINOVIALE
Il liquido prelevato deve essere inviato in provetta K3Edta, unitamente ad uno striscio dello stesso eseguito a fresco ( tal quale -t.q.).
LIQUIDI DI VERSAMENTO
I campioni allestiti da liquidi organici, fra cui liquido peritoneale, pleurico e pericardico, devono essere sempre inviati in una provetta contenente K3Edta (provetta da emocromo), al fine di evitare la formazione di coaguli. Se possibile, inviare contestualmente anche uno striscio a fresco del campione stesso fatto asciugare rapidamente all'aria. Se si richiede l'esame biochimico del versamento, è necessario utilizzare un'ulteriore campione in provetta da siero.
STRISCIO EMATICO
Lo striscio di sangue non deve essere ne eccessivamente lungo ne troppo corto, deve essere formato da tre porzioni, testa corpo e coda. La zona di lettura e' quella compresa tra corpo e la coda che quindi dovra' essere il piu' possibile sottile ( monostrato cellulare).
MIDOLLO OSSEO
Gli strisci effettuati da midollo osseo devono sempre essere accompagnati da un emocromo del soggetto, prelevato nello stesso giorno contestualmente ad uno striscio a fresco, il materiale midollare residuo può essere conservato in una provetta da emocromo.
AGO ASPIRATO LINFONODALE
In caso di linfoadenomegalia sistemica evitare di aspirare i linfonodi retromandibolari. Lo striscio di materiale linfonodale deve essere effettuato con estrema delicatezza per evitare l' eccessiva rottura cellulare.
TIPO DI VETRINI DA UTILIZZARE
Preferibilmente, i vetrini da utilizzare sono quelli che presentano la banda sabbiata in cui inserire l'identificativo, rigorosamente a matita ( mai a penna o pennarello ).Gli stessi dovrebbero essere di buona qualita' e con la molatura sui bordi .Laddove possibile, eseguire almeno 3 preparati da ciascuna lesione, da inviare già fissati all'aria e non colorati. Se si inviano campioni già colorati, specificare il tipo di colorazione eseguita ed inviare contestualmente altri campioni non colorati, al fine di consentire al laboratorio stesso il processamento secondo metodiche standard, con eventuale ricorso a colorazioni differenziali.
SCHEDA DA ALLEGARE
Ricordarsi sempre di compilare una scheda con le seguenti informazioni:
1. segnalamento (specie, razza, età, sesso)
2. tipo di lesione (organo di prelievo e/o localizzazione, aspetto macroscopico, dimensioni …)
3. indicazioni sul tipo di prelievo effettuato (impronta, scarificato, agoaspirato /agoinfissione…)
4. anamnesi (eventuali malattie preesistenti, evoluzione della lesione) ed eventuali sospetti diagnostici
SPEDIZIONE DEI VETRINI
Per l’imballaggio e la spedizione dei vetrini è buona norma utilizzare dei portavetrini rigidi ( plastica ), ed evitare di spedire i vetrini imballati con della semplice carta o liberi in delle scatole, riducendo al minimo il rischio di rottura durante la spedizione. Se si utilizzano portavetrini già utilizzati in precedenza, accertarsi che siano privi di detriti o residui oleosi all'interno, per non contaminare i nuovi preparati.
 TIPOLOGIA DI PROVETTE
TIPOLOGIA DI PROVETTE
Il laboratorio mette a disposizione dei suoi clienti diversi tipi di provette, a seconda del tipo di analisi che si intende eseguire.
Tappo Verde (K3 EDTA)
Esame emocromocitometrico; profilo reticolocitario; determinazione gruppi sanguigni
Tappo Rosa (Trisodio Citrato)
Profilo coagulativo
Tappo Arancione (KF Na2 EDTA)
Glicemia
Tappo Rosso (no anticoagulante)
Profilo biochimico; sierologia; elettroforesi proteica; esami ormonali; monitoraggi terapeutici
Una volta prelevato, il sangue va trasferito nelle apposite provette, rispettando delle semplici regole:
• Evitare sempre di immettere con pressione il sangue con violenza fuori dalla siringa per non provocare l'emolizzazione del campione
• Per le provette con ANTICOAGULANTE (tappo verde, rosa) riversare il sangue tempestivamente all'interno e miscelare delicatamente più volte, al fine di evitare la formazione di coaguli; rispettare la quantità richiesta (normalmente indicata): un eccesso di anticoagulante provoca il “raggrinzimento” delle cellule; un eccesso di campione può determinare la coagulazione dello stesso
• Per le PROVE DI COAGULAZIONE (tappo rosa) è assolutamente necessario sottoporre il campione a centrifugazione immediata e inviare al laboratorio direttamente il plasma in sodio citrato così ottenuto (non il sangue intero) in provette di plastica. Il rapporto tra il citrato di sodio ed il sangue deve essere 1:9 . Nel caso in cui l'anticoagulante sia in eccesso rispetto al plasma ( erroneo allestimento; eritrocitosi )si assiste ad un aumento dei tempi di coagulazione. Viceversa una riduzione della quantità di anticoagulante rispetto al plasma ( eccesso di sangue in provetta; anemia marcata ) comporta una riduzione dei tempi di coagulazione. Si consiglia di effettuare il prelievo dalla giugulare.
• Per tutti gli esami che richiedono l'ulizzo di SIERO (tappo rosso), il laboratorio si raccomanda di inviare quest'ultimo già separato, sottoponendo il sangue intero a centrifugazione (3000 rpm per 10 min) dopo circa 20 minuti d'attesa* (37°C) dal momento del prelievo (*Questo tempo d'attesa può esser ridotto se si utilizzano provette da siero con acceleratori della coagulazione)
• Tutti i campioni dovranno essere mantenuti ad una temperatura di refrigerazione fino all'arrivo in laboratorio.
• Per esami endocrinologici e monitoraggi terapeutici ( soprattutto fenobarbitalemia ) non utilizzare provette con gel separatore.
 ESAME ISTOPATOLOGICO
ESAME ISTOPATOLOGICO
Per l'esecuzione degli esami istopatologi il laboratorio si appoggia ai services esterni BIESSEA e laboratorio SAN MARCO. Di seguito riportiamo alcuni suggerimenti per un corretto campionamento istologico.
• Prelievo: l'esame istopatologico può essere eseguito su campioni bioptici ottenuti per via incisionale (prelievi di un piccolo frammento di tessuto mediante bisturi, punch, tru-cut, pinze endoscopiche...) o escissionale (asportazione chirurgica di lesioni in toto), oppure su prelievi post-mortem.
1. Trattare il campione con grande delicatezza: la compressione esercitata con le dita o con le pinze può provocare fenomeni di schiacciamento sui tessuti.
2. Evitare termocauterio e bisturi elettrici, poiché causa di grave necrosi coagulativa.
3. Scegliere accuratamente la porzione da inviare: se di piccole dimensioni, inviare la lesione in toto; se grande, effettuare prelievi multipli, evitando le aree centrali, normalmente necrotiche ed emorragiche, prediligendo le aree periferiche.
4. Ridurre il campione a dimensioni ottimali per la fissazione, poiché ricordiamo che la formalina penetra bene fino ad un massimo di 1-2 cm di spessore.
• Identificazione dei margini: se si sospetta una neoplasia è opportuno marcare i margini del campione con apposito inchiostro indelebile (inchiostro di china, tempere colorate), oppure con dei punti di sutura.
• Fissazione: i campioni devono essere “fissati” il più rapidamente possibile, ovvero immersi in un liquido che ha lo scopo di preservare i tessuti, bloccando i fenomeni di autolisi e conservandone integra la morfologia. Il fissativo di più largo uso (facile da reperire, conveniente) è la formalina (formaldeide diluita al 10%, tamponata a pH 7-7.2), da impiegare in quantità appropriata (almeno il doppio del volume del campione; rapporto ottimale 1:10). Fissativi “d'emergenza”: alcool denaturato (indurisce eccessivamente), soluzione fisiologica raffreddata. NON CONGELARE!
• Contenitore: infrangibile, di plastica, trasparente/semi-trasparente, a tenuta ermetica, con doppia chiusura e tappo esterno a vite, a bocca larga.
• Identificazione: come per la citopatologia, anche in questo caso è essenziale allegare al campione una apposita scheda d'accompagnamento.
Vi invitiamo a prendere visione preventivamente del documento "LINEE GUIDA ISTOLOGIA SAN MARCO"
 Modulo istologico BIESSEA
Modulo istologico BIESSEA
 Modulo richiesta istologico SAN MARCO
Modulo richiesta istologico SAN MARCO
 Modulo richiesta istologico cutaneo SAN MARCO
Modulo richiesta istologico cutaneo SAN MARCO
 Linee guida istologia SAN MARCO
Linee guida istologia SAN MARCO
 ESAME MICROBIOLOGICO E MICOLOGICO
ESAME MICROBIOLOGICO E MICOLOGICO
ESAME MICROBIOLOGICO
Liquidi organici/ Urine/ Bal: provetta vacutainer sterile oppure in siringa di campionamento
Tamponi: utilizzare i tamponi con terreno di trasporto ( SWAB ) forniti dal laboratorio.
NB: se non inviati immediatamente refrigerare 4-8°C
ESAME MICOLOGICO
MICOLOGICO: Provetta di plastica non sterile.
EMOCOLTURA: Flacone inviato preventivamente dal laboratorio
 PREPARAZIONE DEI CAMPIONI
PREPARAZIONE DEI CAMPIONI
Esame |
Substrato |
Commenti |
EMATOLOGIA |
||
Emocromo |
Sangue intero in K3Edta (refrigerato): min. 1 ml |
Rispettare il giusto rapporto sangue/anticoagulante in funzione della provetta che si ha a disposizione; inviare sempre uno striscio di sangue eseguito a fresco (non colorato, non fissato) |
Profilo Reticolocitario |
Sangue intero in K3Edta (refrigerato): min. 1 ml |
Esame eseguito automaticamente per valori di HCT < 30% (cane) e < 20% (gatto) |
Gruppo sanguigno (cane DEA 1.1; gatto A-B-AB) |
Sangue intero in K3Edta (refrigerato): min. 1 ml |
|
Prove di compatibilità crociata |
Sangue intero in K3Edta (refrigerato): min. 1 ml |
|
PT, Aptt, Fibrinogeno, FDPs, D-Dimeri (solo nel cane), Antitrombina III |
Plasma in sodio citrato |
Rispettare il quantitativo di sangue richiesto dalla provetta (es. 2,5 ml), centrifugare immediatamente ed inviare direttamente il plasma |
Test di Knott |
Sangue intero in K3Edta |
|
CHIMICA CLINICA - Profilo Biochimico completo |
||
Ck, Ast, Alt, Alp, Ggt, Ldh, Bil. Tot, Alb, Chol, Che, Prot. Tot, Trig, Amy, Lip, Gluc, Urea, Crea, Ca, P, Mg, Na, K, Cl, Fe, Uibc, Tibc, Sat, Proteina C reattiva (Cane), Ceruloplasmina (Gatto) |
SIERO refrigerato: 0,7 ml |
Nei campioni inviati non separati o separati in ritardo: possibile ipoglicemia e ipocalcemia |
CHIMICA CLINICA - Profili Biochimici parziali |
||
Urea, Crea, P |
Siero o Plasma (refrigerati): 0,2 ml |
|
Ast,Alt, Alp, Ggt, Bil. tot |
Siero o Plasma (refrigerati): 0,2 ml |
Interferenze: emolisi/ittero |
Amy, Lip |
Siero o Plasma (refrigerati): 0,2 ml |
|
Mg, Ca, Na, K, Cl, Glu |
Siero (refrigerato): 0,2 ml |
|
Che, Ck, Chol, Trig, Prot tot, Alb |
Siero (refrigerato): 0,2 ml |
|
Fe, Uibc, Tibc, Sat |
Siero (refrigerato): 0,2 ml |
Interferenze: emolisi |
Proteina C reattiva |
Siero o Plasma (refrigerati): 0,1 ml |
Interferenze: emolisi/lipemia |
Ceruloplasmina |
Siero (refrigerato): 0,1 ml |
|
Acidi Biliari sierici pre e post.prandiali |
Siero (refrigerato): 0,2 ml |
1° prelievo: a digiuno |
Ca ionico |
Siero (refrigerato): 0,2 ml |
E' indispensabile che il campione arrivi già sierato |
Ferritina (solo cane) |
Siero (refrigerato): 0,2 ml |
|
Aptoglobina (solo cane) |
Siero (refrigerato): 0, 2ml |
|
Fruttosamina |
Siero (refrigerato): 0,2 ml |
Attendibile se il paziente è normo-albuminemico |
Acido Urico |
Siero (refrigerato): 0,1 ml |
|
ELETTROFORESI |
||
Elettroforesi delle Sieroproteine |
Siero (refrigerato): 0,5 ml |
Interferenze: emolisi (aumento della frazione Beta2) |
Elettroforesi delle Lipoproteine |
Siero (refrigerato): 0,5 ml |
|
Elettroforesi Urinaria (SDS - age + Pu/Cu) |
Urine: 1 ml |
|
SIEROLOGIA |
||
Leishmania, Ehrlichia, Rickettisia, IgG Ifat |
Siero (refrigerato): 0,5 ml |
|
Leishmania Ifat |
Siero (refrigerato): 0,3 ml |
|
Ehrlichia Ifat |
Siero (refrigerato): 0,3 ml |
|
Rickettsia Ifat |
Siero (refrigerato): 0,3 ml |
|
Neospora Ifat |
Siero (refrigerato): 0,3 ml |
|
Borrelia Ifat |
Siero (refrigerato): 0,3 ml |
|
Filaria Elisa |
Siero (refrigerato): 0,3 ml |
|
Toxoplasma IgG-IgM |
Siero (refrigerato): 0,3 ml |
|
FiV-FelV Elisa |
Siero (refrigerato): 0,3 ml |
|
Coronavirus (FIP) Ifat |
Siero (refrigerato): 0,3 ml |
|
Chlamydia Psittaci |
Siero (refrigerato): 0,3 ml |
|
ORMONALI / MONITORAGGI TERAPEUTICI |
||
TT4, FT4 |
Siero (refrigerato): 0,3 ml |
|
TT4, FT4, TSH canino |
Siero (refrigerato): 0,3 ml |
|
TT4, FT4 basale e post-stimolazione |
Siero (refrigerato): 0,3 ml |
|
Cortisolo basale e post-stimolazione |
Siero (refrigerato): 0,3 ml |
1)Prelievo Basale |
Cortisolo basse dosi (3 determinazioni) |
Siero (refrigerato): 0,3 ml |
1)Prelievo Basale |
Cortisolo alte dosi (2 determinazioni) |
Siero (refrigerato): 0,3 ml |
1)Prelievo Basale |
TLI, Folati e Vit. B12 |
Siero (refrigerato): 0,5 ml |
|
Fenobarbitalemia |
Siero (refrigerato): 0,3 ml |
Non utilizzare provette con gel separatore. |
 MATERIALE SCIENTIFICO
MATERIALE SCIENTIFICO
Ceruloplasmina
Introduzione
E' una metalloproteina presente nel sangue ( alfa2 glicoproteina), nella cui molecola sono contenuti 8 atomi di di rame. La Ceruloplasmina costituisce la forma di trasporto del rame nel sangue. Le funzioni biologiche della ceruloplasmina sono scarsamente conosciute: si ritiene che la formazione di tale complesso cromoproteico impedisca la deposizione di rame nei tessuti. Una diminuzione dei tassi ematici di Ceruloplasmina nell'uomo si riscontra in una grave malattia ereditaria dell'infanzia, il morbo di Wilson o degenerazione epato-lenticolare, in tale malattia il rame si deposita nel fegato e nei nuclei basali dell'encefalo, provocando insufficienza epatica, disturbi psichici ed incoordinazione motoria.
La nostra esperienza
Il laboratorio Ematos Vet lab gia' dal 2007 ha cominciato a proporre solo nel gatto la Ceruloplasmina nel ruolo di App's ( proteina di fase acuta) a risposta moderata, tutto cio' dopo aver messo a punto la metodica , e contemporaneamente avendola testata su circa 200 campioni. La Ceruloplasmina viene immessa nel torrente circolatorio entro 24 ore dalla noxa patogena, per raggiungere la sua concentrazione massima dopo 3-4 giorni.
Aumenta in corso di:
• Traumi chirurgici e non
• Infiammazioni
• Infezioni
• Neoplasia
• Aei
• Gravidanza
• Utilizzo prolungato di fenobarbital
Diminuisce invece in corso di:
• Malassorbimento/malnutrizione
• Epatite/colangioepatite
• Sindrome nefrosica
• Epatopatia grave
• Utilizzo di estroprogestinici
 MATERIALE SCIENTIFICO
MATERIALE SCIENTIFICO
10 consigli per il coagulativo
E' fuori di dubbio che la coagulazione sia un complesso di eventi normalmente regolato in condizioni fisiologiche da numerosi fattori (integrita' vascolare , numero di piastrine , funzionalita' delle stesse, cascata coagulativa), e quindi per sua stessa natura sottoposto a numerose influenze ed interferenze, ed e' uno di quei test ematici di complessa valutazione / interpretazione. Senza entrare nello specifico, si ricordano alcune azioni fondamentali per ottenere un campione ideale ed evitare cosi' errori preanalitici.
1. per ottenere un buon campione e' necessario mettersi nelle migliori condizioni di prelievo. Luce adeguata, controllo del soggetto attraverso l'ausilio di una seconda persona, preparazione della provetta idonea , con relativa identificazione, prima di eseguire il prelievo ( ricordarsi che e' necessario utilizzare provette con anticoagulante citrato di sodio il rapporto da conseguire e' 1 parte di anticoagulante 9 di sangue. (es 0.25 ml di citrato di sodio prevedono di immettere 2.25 ml di sangue intero nella provetta.). Uno degli obiettivi principali dell' operatore che andrà ad effettuare il prelievo è ridurre l'ansia del paziente, che è uno dei fattori generali di vasocostrizione. Un'atmosfera calma è il requisito più importante per realizzare un buon prelievo.
2. Utilizzare sempre vasi di grosso calibro. Meglio la giugulare della radiale o safena.
3. Evitare l'utilizzo di lacci emostatici, la stasi prolungata altera tutti i parametri ematochimici compresi quelli emostatici.
4. Se vi rendete conto durante il prelievo che il sangue viene campionato con difficolta', prelievi traumatici/lenti, non corretto posizionamento dell'ago nel vaso, utilizzate un nuovo vaso.
5. Una volta ottenuto il materiale ,immetterlo nella provetta seguendo le diluizioni di cui sopra, e miscelare per inversione in maniera delicata per 1 minuto.
6. Centrifugare il campione per 4-5 minuti a 1500-2000 giri (rpm).
7. Si otterra' il plasma che dovra' essere separato in una seconda provetta di plastica senza alcun anticoagulante.
8. Evitare prelievi emolitici/lipemici gia' parzialmente coagulati.
9. Conservare in frigorifero 2-4 °C.
10. Un alterato rapporto sangue/anticoagulante potra' interferire sui tempi di coagulazione.
 MATERIALE SCIENTIFICO - VALUTAZIONE DELLA PROTEINURIA SDS-AGE
MATERIALE SCIENTIFICO - VALUTAZIONE DELLA PROTEINURIA SDS-AGE
ELETTROFORESI DELLE PROTEINE URINARIE.
La proteinuria può essere talvolta il primo e/o unico dato di laboratorio indicante la presenza di una nefropatia in soggetti asintomatici. Dopo averne escluso l'origine pre- o post-renale e dopo averlacaratterizzata dal punto di vista quantitativo (ad es. mediante misurazione del rapporto Proteine Urinarie/Creatinina Urinaria), un corretto e completo approccio diagnostico dovrebbe includereanche una valutazione QUALITATIVA della proteinuria stessa, per localizzare al meglio il danno renale.
Sapendo che, in condizioni di normalità, il glomerulo consente il passaggio di piccole frazioni di albumina (circa 69 kDa e non superiori) e polipeptidi a basso peso molecolare (1,5-69 kDa) che vengono poi riassorbiti a livello di tubulo prossimale, il riscontro di proteine urinarie ad alto o basso peso molecolare suggerisce al clinico la presenza di un danno rispettivamente a livello glomerulare o tubulare (o entrambi).
Ad oggi è possibile separare le singole frazioni proteiche urinarie mediante elettroforesi su gel d'agarosio, previo trattamento con detergente anionico SDS (Sodio Dodecil Solfato) il quale, legandosi alle proteine, le denatura e le carica negativamente in maniera uniforme, annullandone le differenze di carica: in tal modo queste migreranno e si separeranno attraverso il gel esclusivamente in funzione del loro peso molecolare, rendendo agevole la distinzione tra proteine di origine glomerulare (>69 kDa) o tubulare (<69 kDa).
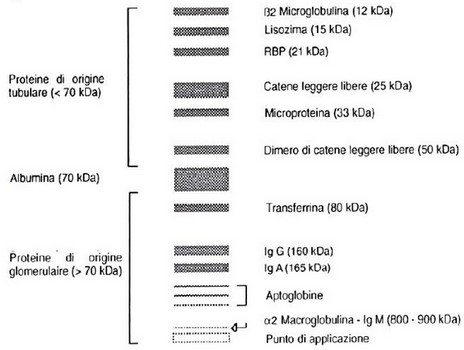
In particolare, i diversi “pattern” di proteinuria riscontrabili sono:
1. GLOMERULARE (“macro-proteinuria” per lesione a carico delle pareti dei capillari glomerulari)
2. selettiva: perdita di albumine e proteine >69 kDa, ma <150 kDa
3. non selettiva: perdita di albumine e proteine > o uguali a 150 kDa
4. TUBULARE (“micro-proteinuria” per lesione a carico di tubulo o interstizio e difetto di riassorbimento)
5. incompleta: perdita di proteine tra 23 e 69 kDa
6. completa: perdita di proteine tra 14 e 69 kDa
7. MISTA: presenza contemporanea di proteine glomerulari e tubulari
In aggiunta alla valutazione del danno renale, ricordiamo inoltre che tale metodica può essere utilizzata come ausilio diagnostico nella pratica oncologica, per la ricerca delle frazioni kappa e lambda (catene leggere, circa 20 kDa) di immunoglobuline prodotte da parte di alcune neoplasie (es. Mieloma Multiplo) ed eliminate per via urinaria sotto forma di “proteinuria di Bence-Jones”.
Tecnologia | Esami | Materiali |
| SCOPRI I NOSTRI MACCHINARI | TUTTI GLI ESAMI DI LABORATORIO | MODALITA' DI CAMPIONAMENTO |